Einführung/Hintergrund
Zelluläre Kommunikation durch Wnt-Signalisierung
Zellen, die Grundeinheiten des Lebens, müssen miteinander kommunizieren, um voll integrierte, komplexe Lebewesen zu bilden. Unsere Arbeit konzentriert sich auf einen bestimmten kurzen Zell-zu-Zell-Signalweg, das so genannte Wnt-Signal. Der Wnt-Signalweg steuert eine Vielzahl von biologischen Prozessen während der Entwicklung und der erwachsenen Homöostase von multizellulären Tieren (Metozoen). Obwohl seit der Entdeckung dieses grundlegend wichtigen Pfades in den frühen 90er Jahren viel Wissen gewonnen wurde, sind viele der molekularen Details und Mechanismen, die von Zellen verwendet werden, um eine präzise regulierte Wnt-Signalisierung zu erreichen, nach wie vor schwer fassbar. Ein besseres Verständnis der Wnt-Signalereignisse wird nicht nur unser Verständnis dafür verbessern, wie sich multizelluläre Organismen entwickelt haben, sondern auch von großer medizinischer Bedeutung sein, wenn man die gut dokumentierte Bedeutung der Wnt-Signalisierung für menschliche Krankheiten wie Krebs und Neurodegeneration berücksichtigt.
Wnt ist der Name für die lipidmodifizierten Signalproteine, die aus "Quell"-Zellen (Wnt produzierende Zellen) freigesetzt werden, und es sind 19 verschiedene Wnt-Proteine bekannt. Sie lösen zelluläre Signalereignisse in benachbarten "reagierenden" Zellen aus, wenn sie mit kognitiven Wnt-Rezeptoren in Kontakt kommen, die sich auf der Zelloberflächenmembran dieser reagierenden Zellen befinden (siehe Abbildung 1 unten).
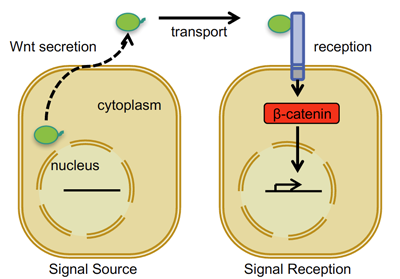
Abbildung 1. Vereinfachte schematische Darstellung des Wnt/beta-Catenin-Zell-Zell-Zell-Signalweges
Es gibt mehrere Wnt-Rezeptoren, von denen die zehn verschiedenen Frizzled-Rezeptoren und mindestens zwei Co-Rezeptoren aus der Familie der Lipoprotein-Rezeptoren (LRP5 und LRP6) für den Bereich der Wnt-Signalisierung relevant sind, auf den wir uns konzentrieren: die sogenannte Wnt/Beta-Catenin-Signalisierung. Wie in Abbildung 1 dargestellt, führt die Aktivierung der Wnt/beta(β)-Catenin-Signalisierung in antwortenden Zellen zu Veränderungen in der Expression spezifischer Zielgene (Wnt-Zielgene).
Weitere Informationen zum Wnt-Signalweg finden Sie unter "Die Wnt-Homepage":
http://web.stanford.edu/group/nusselab/cgi-bin/wnt/
Innerhalb des KIT ist es unser Ziel, mit interdisziplinären Ansätzen einige der offenen Fragen rund um die Wnt-Signalisierung zu beantworten.
Forschung und Technologien
- CRISPR/Cas Genom-Engineering zur Herstellung von Zellen mit endogen markierter Wnt-Streckenkomponente
CRISPR/Cas9 ist zu einer routinemäßigen Genbearbeitungsmethode geworden und wir verwenden sie, um Wnt-Streckenkomponenten endogen mit z.B. fluoreszierenden Proteinen zu markieren. Dies ermöglicht es, eine Reihe von bildgebenden und biophysikalischen Methoden an Zellen durchzuführen, die solche fluoreszierend markierten Komponenten unter physiologisch relevanten Bedingungen enthalten.
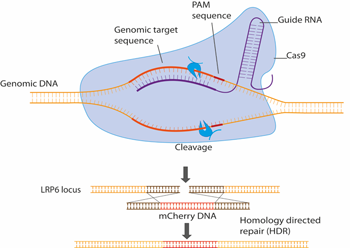
Abbildung 2. Schematische Darstellung des LRP6 endogenen Tagging mit CRISPR/Cas9. Hier wird das fluoreszierende Protein mCherry in den endogenen LRP6-Genlocus eingebracht, was zur Bildung eines LRP6-mCherry-Fusionsproteins führt, das in lebenden Zellen mit fluoreszenzmikroskopischen Methoden visualisiert werden kann.
- Fluoreszierende Markierung von Wnt-Streckenliganden und Wnt-Rezeptoren zur Visualisierung von Ligandenrezeptor-Interaktionen in Zellen
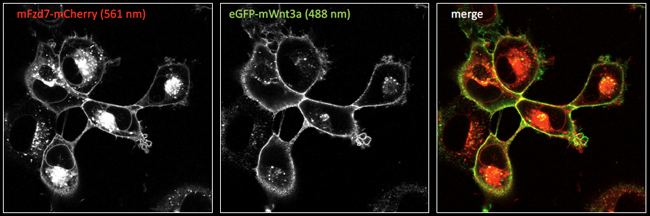
Abbildung 3. Fluoreszenzmikroskopische Bilder (Laser-Scanning-Konfokalmikroskopie) von Zellen, die mCherry-tagged Frizzled7 (Fzd7) Rezeptoren exprimieren, mit extrazellulär gebundenem eGFP-getagtem Wnt3a
- Hochdurchsatz Zellbasierte Screening-Assays zur Identifizierung neuer Modifikatoren der Wnt-Signalisierung.
Um neue Komponenten zu identifizieren, die zur Regulierung der Wnt-Signalisierung beitragen, wird ein zellkulturbasiertes Expressionsscreening durchgeführt. Eine Möglichkeit, dies zu tun, ist die Co-Expression einer ausgewählten Wnt-Streckenkomponente zusammen mit einer großen Sammlung von Genen und das Screening nach einem gewünschten Messwert, wie z.B. Wnt-Signalisierungsaktivität oder Modifikation der Wnt-Streckenkomponente. Um beispielsweise potenzielle Modifikatoren des Wnt-Ko-Rezeptors LRP6 zu identifizieren, kotransfizieren wir Zellen mit LRP6 und Pools von cDNA-Klonen.
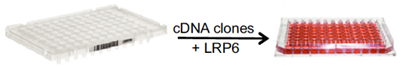
Abbildung 4. Beispiel eines zellbasierten cDNA-Expressionsscreens im 96-Well-Format, bei dem funktionelle Modifikatoren des Co-Rezeptors LRP6 aus großen Gensammlungen (cDNA-Klone) bei ihrer Co-Expression in Zellen identifiziert werden.
Interdisziplinäre Forschung
In Zusammenarbeit mit anderen Gruppen innerhalb des IBCS-FMS und anderen Instituten am KIT nutzen wir neue Technologien zur Unterstützung unserer Forschung, wie z.B.:
- Mikrostrukturierung von Oberflächen für das zelluläre Screening (Pavel Levkin)
- Biophysikalische Analyse von Liganden-Rezeptoren-Interaktionen (Ulrich Nienhaus)
- Kombinatorische Chemie und Zellscreening für die Genversorgung (Pavel Levkin)
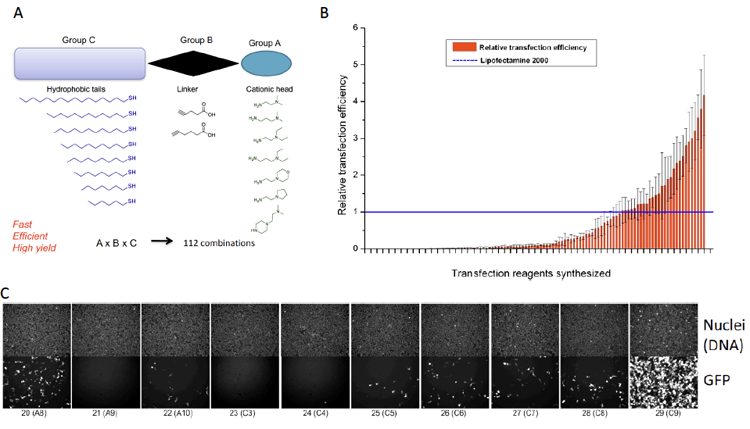
Abbildung 5. Beispiel eines interdisziplinären Projekts an unserem Institut (in Zusammenarbeit mit Dr. Pavel Levkin). Die kombinatorische Chemie wurde zur Synthese einer Bibliothek von neuartigen lipidähnlichen Molekülen (A) verwendet. Diese Moleküle wurden verwendet, um neuartige liposomale Reagenzien herzustellen, die anschließend auf ihre Fähigkeit getestet wurden, GFP-Plasmid-DNA in Zellen (B und C) zu liefern.
Technologietransfer
In Zusammenarbeit mit Dr. Pavel Levkin gründeten wir ein Biotech-Unternehmen auf Basis unserer proprietären Technologie, die ScreenFect®GmbH, die unsere neuartigen ScreenFect®-Transfusionsreagenzien vermarktet (siehe Abbildung 5).

